⚛️Todo lo que necesitas saber sobre el tema de ENLACE QUÍMICO para preparar la selectividad y PCE⚗️
¡Prepárate para la EBAU y las PCE con nuestro especial sobre Enlace químico!
Descubre todo sobre el enlace químico en nuestro post de la serie para la selectividad de química. Aquí te contamos exactamente lo que necesitas saber para dominar este tema. Te daremos los mejores trucos para resolver ejercicios tipo, te mostraremos los errores más comunes y responderemos a esas preguntas que siempre surgen con el enlace químico. Estamos más que acostumbrados a resolver estas dudas y queremos que las interiorices y asimiles completamente. ¡Vamos a por ello!
⚛️¿Qué me pueden preguntar del tema de Enlace Químico?
Tenemos 3 tipos de enlace que vamos a tratar de manera resumida y esquemática:
1️⃣ Enlace iónico
- Entre Metal + No metal (elementos de distinta EN)
- Se da por TRANSFERENCIA ELECTRÓNICA
- Se forman iones de signo opuesto que se atraen por fuerzas electrostáticas.
- Forman una red cristalina altamente ordenada.
Ejemplo: Cualquiera de las combinaciones de elementos del grupo 1 y 2 (excepto H y Be, que forman enlaces covalentes) con no metales: NaCl, CaO, MgF₂…
Para predecir algunas propiedades, como la solubilidad o la fuerza del enlace, es fundamental conocer la Energía Reticular: Ur
La energía reticular es la energía desprendida (negativa) cuando se forma un mol de compuesto iónico a partir de los iones en estado gaseoso.
- Ur aumenta:
- a mayor carga iónica
- a menor radio iónico
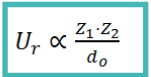
- A mayor Ur, mayor estabilidad del cristal y mayor energía desprendida en su formación. Por tanto:
- A mayor Ur, mayor punto de fusión y ebullición.
- A menor Ur, mayor solubilidad
Para calcular la Er debes realizar el Ciclo de Born-Haber. ¿No sabes cómo? En este ejercicio de examen resuelto te lo explicamos.
🧪¿Qué me pueden preguntar sobre ENLACE IÓNICO?
- Predecir cuáles moléculas iónicas son más o menos solubles considerando la energía reticular (Er).
- Determinar qué moléculas iónicas presentan un punto de fusión y ebullición más alto o más bajo en función de la energía reticular (Er).
- Evaluar si un compuesto específico es conductor en estado sólido y/o en disolución.
- Predecir la fórmula molecular de un compuesto iónico.
2️⃣Enlace COVALENTE
- Entre No metal + No metal (elementos de EN parecida)
- Se da por COMPARTICIÓN de ELECTRONES
- Puede ser simple, doble y triple
Ejemplo: El enlace entre los átomos de hidrógeno (H) y oxígeno (O) en el agua (H₂O) es covalente.
🧪¿Qué me pueden preguntar sobre ENLACE COVALENTE?
- Representar la estructura de Lewis de la molécula.
- Determinar la geometría molecular y la geometría electrónica espacial aplicando la teoría de repulsión de pares electrónicos de la capa de valencia (TRPEV).
- Ordenar compuestos en función a su ángulo de enlace.
- Evaluar la polaridad de la molécula.
- Identificar la hibridación del átomo central.
- Determinar qué moléculas tienen mayor o menor punto de fusión y ebullición atendiendo a las fuerzas intermoleculares.
.🧪Consejos y trucos para dibujar la estructura de Lewis:
- Utiliza la siguiente fórmula: Cálculo de pares enlazantes y pares libres
- n = e⁻ para el estado de octeto (8 para la mayoría)* ver excepciones.
- v = e⁻ de valencia del átomo.
- c = n – v: e⁻ compartidos →c/2: enlaces
- s = v – c: e⁻ solitarios →s/2: pares libres
* Excepciones:
- át. hipovalentes: 2 para H, 4 para Be y 6 para B en compuestos como BH₃ y BCl₃
- át. hipervalentes: 12 S y P 10 pej: PCl₅ y SCl₆
- Reglas para escribir la estructura de Lewis
- El átomo central el más electropositivo.
- Halógenos (F, Cl, Br, I) y H son átomos terminales (nunca centrales), no forman dobles/triples enlaces. Excepciones en moléculas como: ClO₃⁻; ClF₃, ICl₂⁺.
- Coloca el átomo central con sus e⁻ de valencia y rodea con átomos periféricos con sus e⁻ de valencia.
- Asigna enlaces. Si faltan enlaces para átomos periféricos, puede haber dobles o triples enlaces.
- Cumple la regla del octeto: 8 e⁻ alrededor de cada átomo (excepto H con 2) y considera átomos hipo/hipervalentes.
- Ajusta e⁻ para cargas: quita un e⁻ para carga + y añade un e⁻ para carga -. Pon la molécula entre corchetes señalando la carga.

Aquí tienes un esquema con 21 estructuras de Lewis complejas que podrían aparecer en los exámenes de selectividad y PCE.
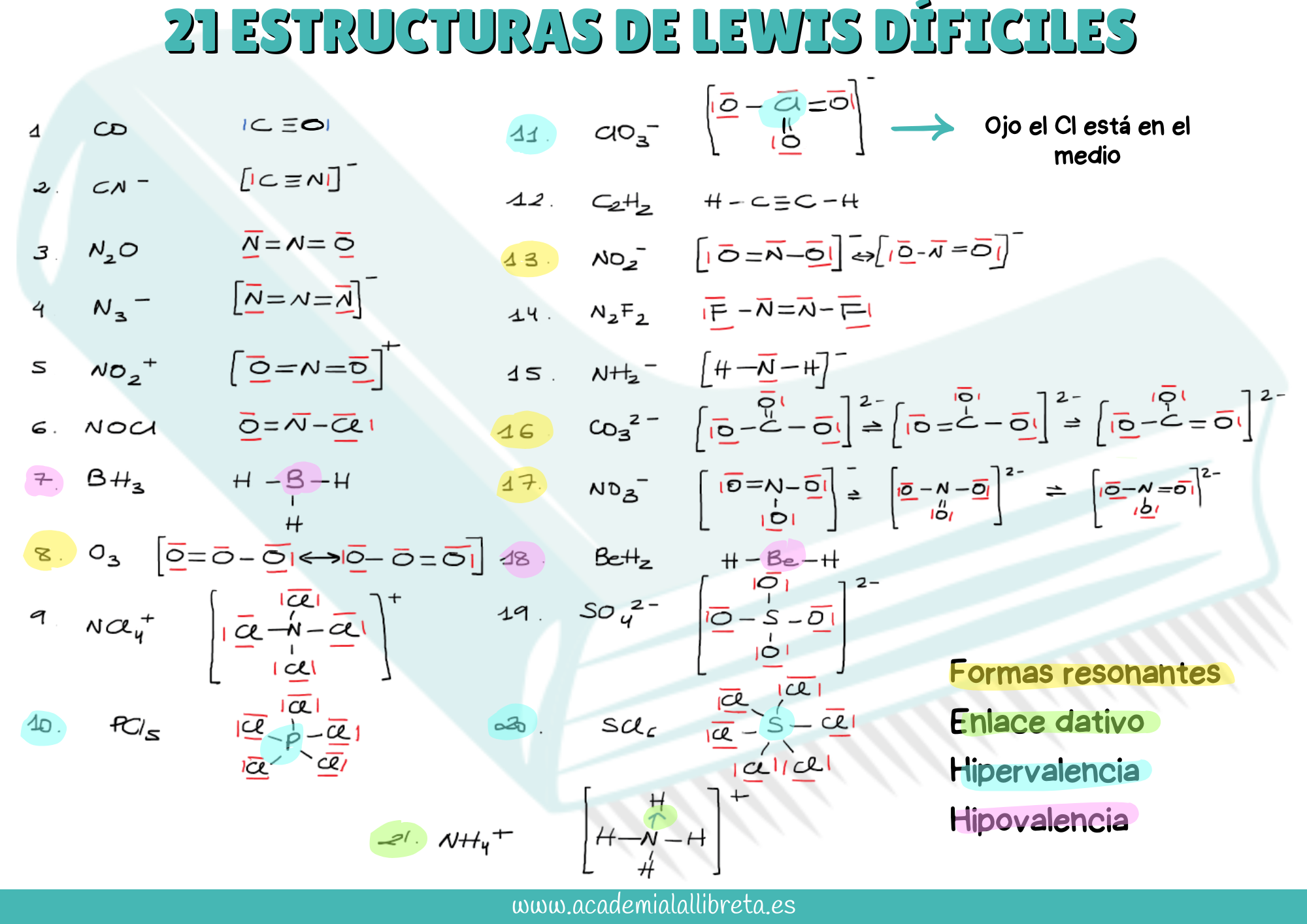
🧪Otras estructuras de Lewis difíciles en las que aparecen halógenos
ClF₃, ICl₂⁺
En la molécula ClF₃ ten cuenta que el flúor no puede tener más de ocho electrones de valencia en su valencia porque está en el segundo periodo, mientras que el Cl sí puede ser hipervalente.
🧪Consejos y trucos para determinar la geometría molecular
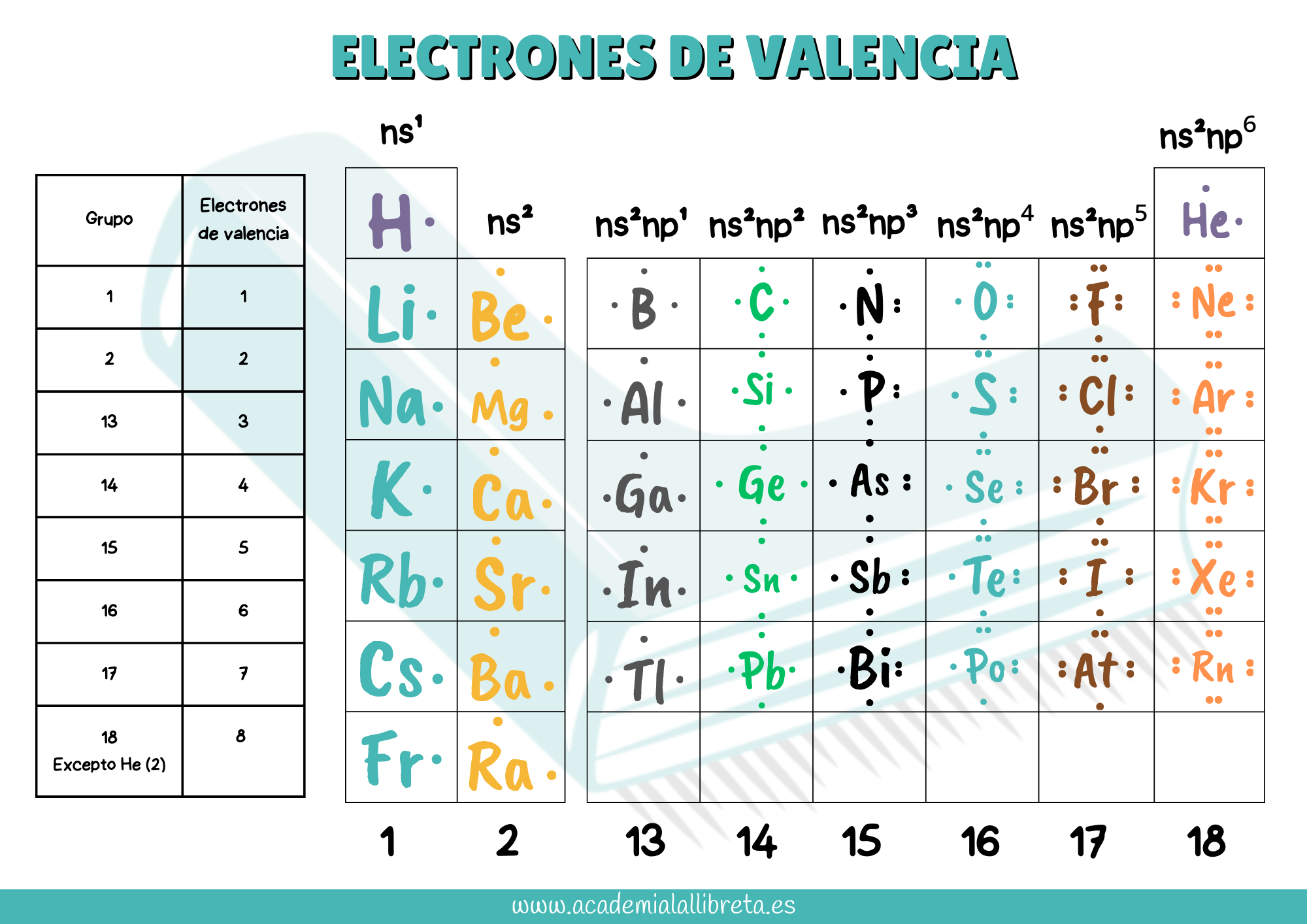
Para dominar la geometría molecular, es esencial comenzar con una base sólida en la tabla periódica. Aquí te explicamos cómo hacerlo paso a paso:
- Esquematiza la Tabla Periódica: Dibuja una versión simplificada de la tabla periódica en un borrador. Utilízala para anotar los elementos que te asignen en los ejercicios y conocer sus electrones de valencia.
- Memoriza los Elementos Clave: Conoce la posición, el nombre y el símbolo de los elementos representativos. Esta habilidad te permitirá identificar rápidamente los electrones de valencia de cada átomo, cruciales en la formación de enlaces. Te dejamos una tabla de ejemplo.
- Relación entre Grupos y Geometría Molecular: Es fundamental entender que elementos del mismo grupo en la tabla periódica, como por ejemplo el oxígeno y el azufre, generan moléculas con las mismas geometrías. Por ejemplo, tanto el agua (H₂O) como el sulfuro de hidrógeno (H₂S) comparten la misma geometría molecular. Esta similitud se extiende a otras moléculas: los halógenos, como el cloro en el Cl₂O, tienden a ser átomos terminales y no forman enlaces múltiples, lo que resulta en estructuras moleculares predecibles. Comprender estas relaciones te permitirá prever la geometría de nuevas moléculas basándote en su composición elemental.
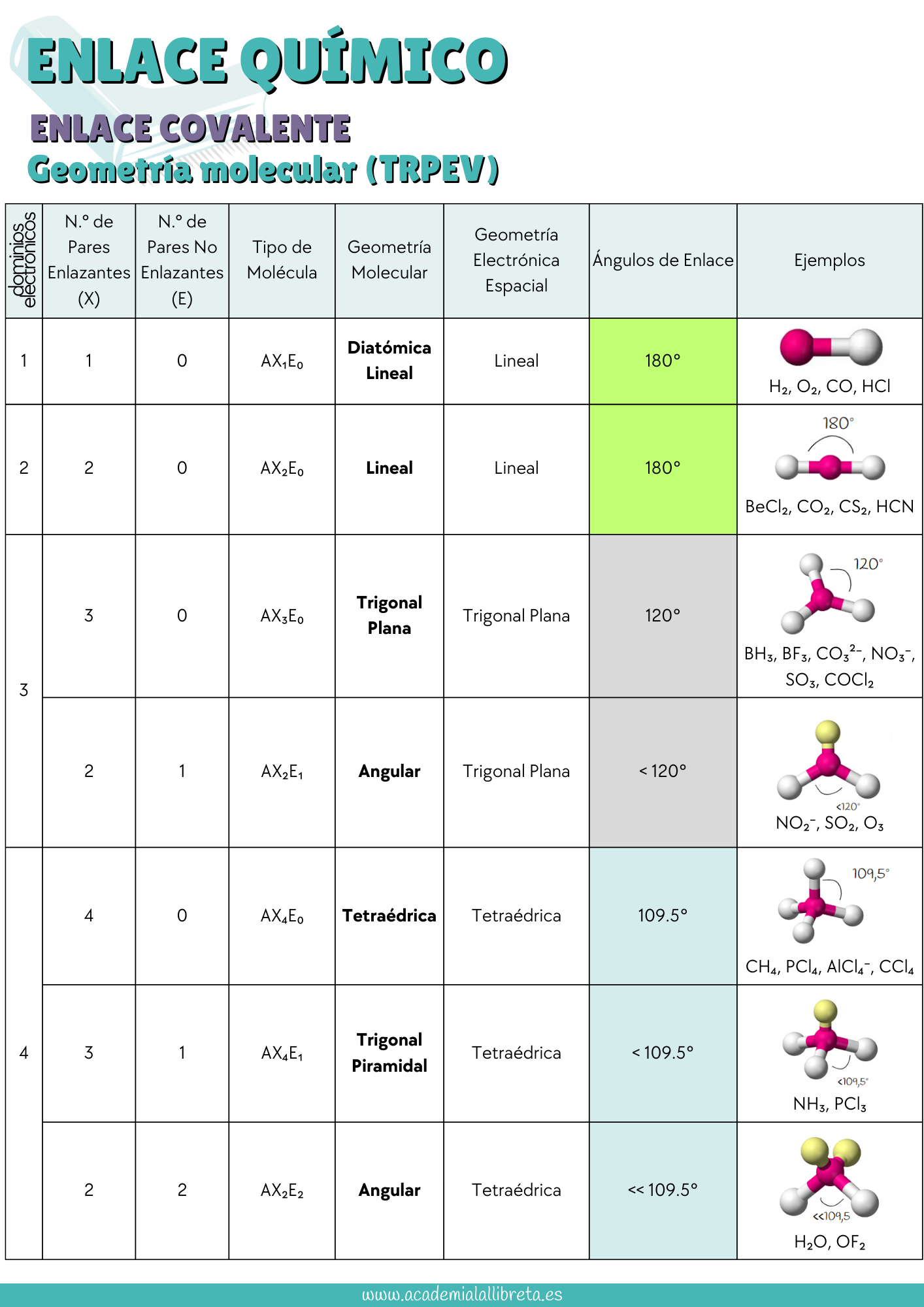
- Determinación de la Geometría Molecular: Observa cuidadosamente el átomo central, así como los átomos y los pares de electrones libres que están enlazados a este. Por ejemplo, en el trifluoruro de boro (BF₃), que se clasifica como AB₃E₀, se adopta una geometría trigonal plana. Esto se debe a que los pares electrónicos buscan maximizar la distancia entre sí, situándose a ángulos de 120°. Es fundamental que te familiarices con los nombres de las geometrías más comunes y que entiendas el concepto de dominios electrónicos, pues estos son los que definen la disposición espacial de los electrones alrededor del átomo central y son objeto de preguntas de examen.
Te dejamos una tabla resumen para que te las aprendas.
3️⃣Enlace MÉTALICO
- Se origina entre metales.
- Tienen baja EI y orbitales moleculares vacíos y accesibles.
- Los átomos se ionizan y se quedan cargados +.
- Los electrones deslocalizados se mueven libremente al rededor de los cationes y funcionan como pegamento electrostático.
🧪¿Qué me pueden preguntar sobre ENLACE METÁLICO?
- Comprender la teoría del mar de electrones y la teoría de bandas.
- Conocer y explicar las propiedades características de los metales.
📄Resumen de estrategias para preparar el tema de Enlace
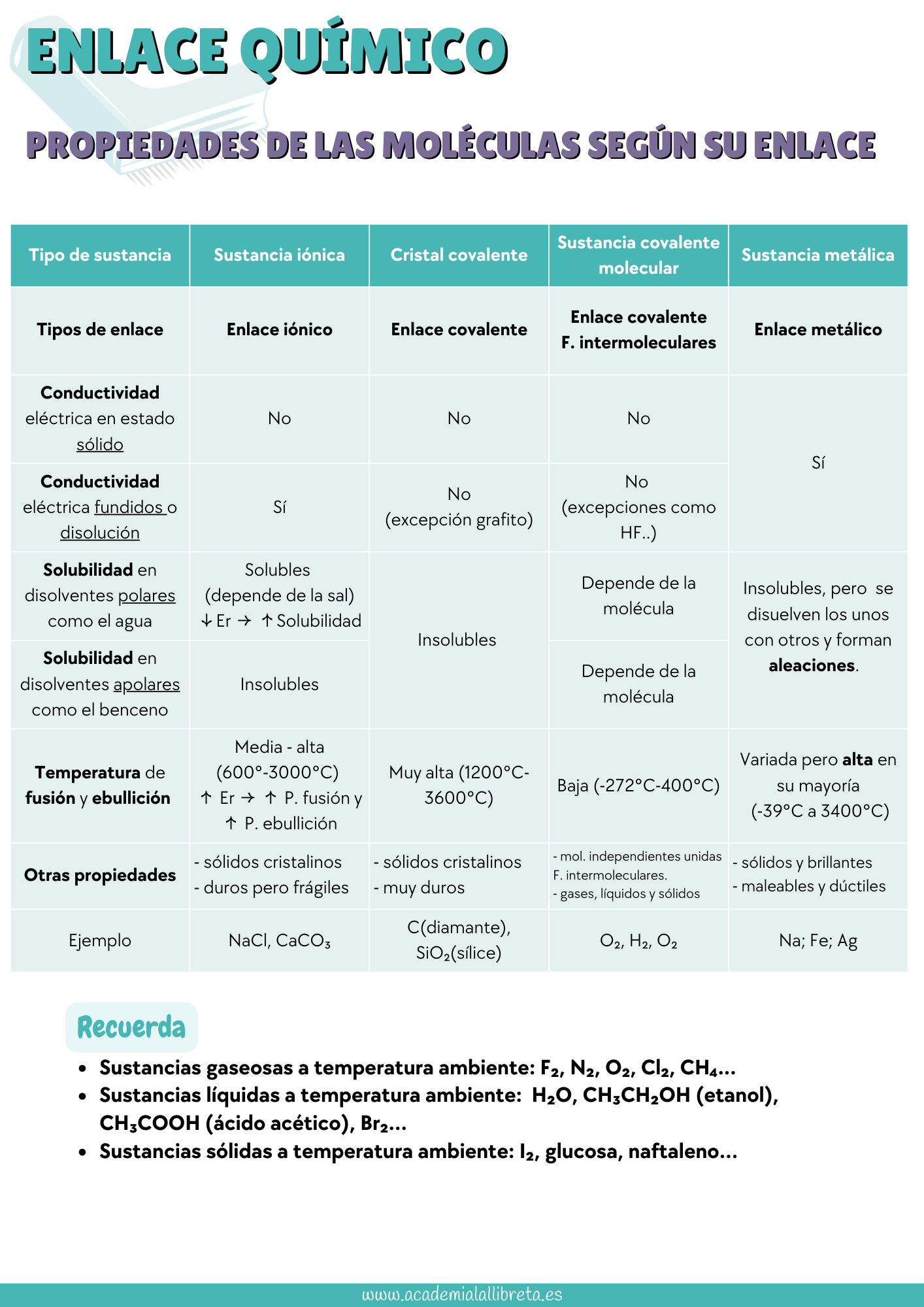
Lo más importante, una vez comprendida la teoría, es practicar con ejemplos de examen. Aquí te dejamos las listas de distribución de los exámenes de la PAU y PCE resueltos en vídeo. Además, incluimos una tabla resumen sobre las propiedades de las moléculas según el tipo de enlace, que puede ser muy útil para responder preguntas teóricas.
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
Este año, como novedad, lanzamos NUESTROS EXCLUSIVOS RESÚMENES DE QUÍMICA, cuidadosamente diseñados para destacar los conceptos clave más importantes de cada tema. Estos resúmenes están disponibles por solo 8€ y son una herramienta esencial para tu aprendizaje.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Conectores para la PAU: tipos, ejemplos y cómo mejorar tu redacción
Descubre cómo evitar errores ortográficos con palabras homófonas en la PCE 2025. Aprende las reglas clave y practica con ejercicios interactivos.
Cuentos de Emilia Pardo Bazán en la PAU 2026: cómo estudiarlos bien y no perder puntos en Lengua
Os contamos todas las novedades del nuevo modelo de Castellano de la PAU 2026. Ten en cuenta todos los cambios de este nuevo curso y preparáte para sacar la mejor nota. Para cualquier consulta, nuestro equipo docente estará encantado de ayudarte.
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
📝Formulario de Matemáticas para Selectividad PAU y PCE (descarga gratuita)
Descarga nuestro formulario gratuito de Matemáticas para Selectividad PAU y PCE: todas las fórmulas e identidades resumidas en dos páginas. Ideal para repasar y mejorar tus resultados. Incluye los enlaces a nuestros cursos para que puedas prepararte con nosotras.
✨ Ejercicios de Derivadas: Evita los Errores Tontos y Domínalas (PAU, PCE, +25)
Practica las derivadas con ejercicios paso a paso y aprende a evitar los errores más comunes de PAU, PCE y +25. Esquemas visuales, trucos, ejemplos claros y tests interactivos para que entiendas las matemáticas de verdad.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!

