⚛️Primer Principio de la Termodinámica explicado: Termoquímica y recursos clave⚗️
¡Prepárate para la PAU y las PCE con nuestro resumen sobre el primer principio de Termodinámica!
Descubre los conceptos clave sobre el primer principio de la Termodinámica de forma sencilla y organizada. Este resumen está diseñado para ayudarte a entender los principios fundamentales y preparar tus exámenes de selectividad y PCE con éxito. ¡Vamos a ello!
Aprovecha años de experiencia docente condensados en consejos prácticos que te ayudarán a evitar los errores típicos y a enfocarte en lo crucial. ¡No te pierdas este recurso valioso para maximizar tu preparación!
⚛️¿Qué es la Termoquímica?
La Termoquímica es una rama de la Química Física que estudia las transformaciones de energía, especialmente el calor y trabajo, conceptos que están estrechamente ligados al Primer Principio de la Termodinámica.
¿Qué es la Energía?
La energía es la capacidad de un sistema para realizar trabajo o transferir calor. Es fundamental en todos los procesos químicos y físicos.
Ejemplo visual: Imagina una pelota en la cima de una colina. Al estar en esa posición elevada, tiene «energía potencial», que es la capacidad de realizar algo, en este caso, caer. Si soltamos la pelota, esta empieza a rodar colina abajo y su «energía potencial» se transforma en «energía cinética», que es la energía del movimiento. Esto muestra cómo la energía puede cambiar de forma, pero siempre está presente, aunque no podamos verla.
⚛️ Tipos de Sistemas Termodinámicos
- Sistema abierto: Intercambia materia y energía con el entorno. Ejemplo: una olla hirviendo sin tapa permite que el agua y el calor salgan hacia el aire.
- Sistema cerrado: Intercambia solo energía, no materia. Ejemplo: una botella cerrada calentándose, donde el calor entra, pero la materia permanece dentro.
- Sistema aislado: No intercambia ni materia ni energía con el entorno. Ejemplo: un termo sellado que conserva el calor y la materia en su interior.
⚛️ Variables Termodinámicas
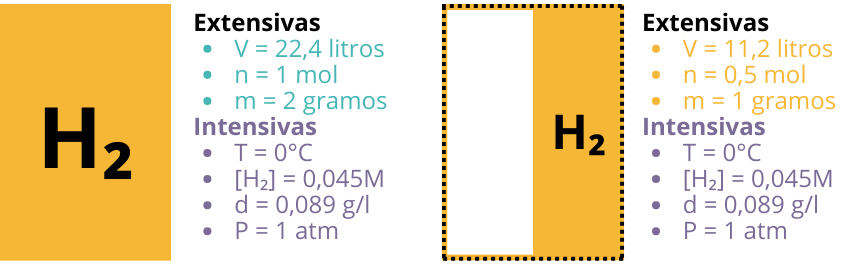
Las variables termodinámicas son magnitudes que describen el estado de un sistema, por ejemplo, la presión, el número de moles, el volumen….. y nos ayudan a entender cómo interactúan con el entorno. Para facilitar su comprensión, puedes visualizar ejemplos prácticos con el siguiente esquema que diferencia entre variables extensivas e intensivas.
- Extensivas: Estas dependen de la cantidad de materia. Por ejemplo, si tienes 1 mol de H₂ y lo divides por la mitad, obtendrás 0.5 moles, y lo mismo ocurre con el volumen o la masa: estas variables cambian proporcionalmente al tamaño del sistema.
- Intensivas: Estas no dependen de la cantidad de materia. Por ejemplo, si tienes una concentración de H₂ de 0.045 M y divides el sistema en dos partes iguales, la concentración seguirá siendo la misma. Esto es similar a cuando tomas una cucharada de café de una taza: el sabor, color y aroma del café no cambian, ya que estas son propiedades intensivas.
⚛️ Funciones de Estado
Las funciones de estado son propiedades que dependen únicamente del estado inicial y final del sistema, sin importar cómo se llegó allí. Estas incluyen:
- Energía interna (U): Representa la suma de todas las energías del sistema.
- Entalpía (H): Mide el calor en procesos a presión constante.
- Entropía (S): Mide el desorden del sistema.
- Energía libre de Gibbs (G): Determina la espontaneidad de un proceso.
Un ejemplo claro es la temperatura: si un sistema pasa de 20°C a 30°C, no importa si lo hizo rápidamente o en etapas, la diferencia de temperatura sigue siendo 10°C.
🔔 Recordatorio: El trabajo (W) y el calor (Q) NO son funciones de estado, ya que dependen del camino seguido. Esto significa que el valor de W y Q varía según cómo se realice el proceso, a diferencia de las funciones de estado como la entalpía o la energía interna.
⚛️Primer Principio de la Termodinámica
El Primer Principio de la Termodinámica establece la ley fundamental de conservación de la energía. Este principio nos dice que la energía total de un sistema y su entorno permanece constante, aunque pueda transformarse de una forma a otra.
El cambio en la energía interna (ΔU) de un sistema es igual a la suma del calor (Q) y el trabajo (W) intercambiados con el entorno. Recuerda que al ser valores de energía tanto la U como el Q y el W se miden el julios (J).
Fórmulas clave:
- ΔU = Q + W
- W = -P ⋅ ΔV
Pero, ¿qué es la energía interna? A nivel atómico, la energía interna es la suma de las energías cinéticas de las partículas debido a su movimiento (vibración, rotación y traslación) y las energías potenciales asociadas a las fuerzas que las mantienen unidas o interactúan entre sí.
⚛️Criterio de Signos
En Termoquímica, es importante interpretar correctamente los signos de las magnitudes, ya que nos indican la dirección del intercambio de energía. Para entenderlo mejor, recuerda: todo «esfuerzo» que realiza el sistema hacia el exterior disminuye su energía interna, mientras que cualquier «esfuerzo» realizado sobre el sistema aumenta su energía interna, y por eso será positivo. Este enfoque facilita visualizar cómo la energía fluye en diferentes procesos.
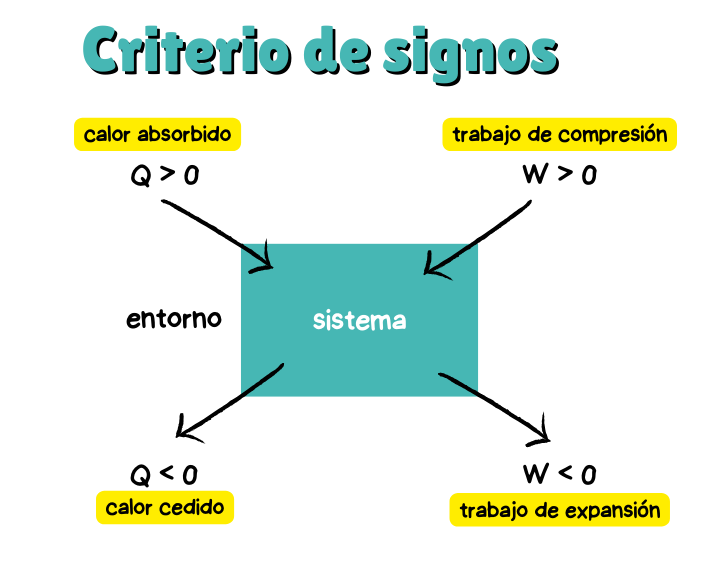
Criterio de signos calor y trabajo
⚛️Tipos de Procesos Termodinámicos
Los procesos termodinámicos se clasifican en función de las variables que se mantienen constantes durante su desarrollo. Cada tipo tiene aplicaciones específicas en la química y en otros campos.
- Isobáricos (P constante): Qp = ΔH
- Isócoros (V constante): ΔU = Qv
- Isotérmicos (T constante): Q = -W
Relación Qp y Qv

Relación Qp y Qv
En esta sesión, extraída de nuestro curso de química en videoclases, te explicamos en profundidad los casos específicos y el origen de la entalpía. Revisa el vídeo y, si tienes alguna duda, no dudes en dejarnos un comentario en este post. ¡Estamos aquí para ayudarte!
⚛️Entalpía (ΔH)
La entalpía es una medida del calor involucrado en una reacción química a presión constante. Se define matemáticamente como H = U + PV, donde U es la energía interna del sistema, P es la presión y V es el volumen. Esta relación nos ayuda a entender si una reacción libera o absorbe energía en forma de calor en condiciones constantes de presión. La mayor parte de los ejercicios que suelen aparecer en los exámenes de química incluyen cálculos de entalpía, ya que es un concepto clave para analizar reacciones químicas y procesos energéticos.
La entalpía mide el calor absorbido o desprendido en una reacción química a presión constante.
- Reacción endotérmica: ΔH > 0 (absorbe calor).
- Reacción exotérmica: ΔH < 0 (libera calor).
⚛️Ley de Hess
La Ley de Hess nos permite calcular la entalpía de una reacción química (ΔHºr) sumando las entalpías de reacciones intermedias conocidas. Es una herramienta esencial para resolver problemas termodinámicos complejos.
⚛️Cálculo de ΔH
El cálculo de la entalpía se puede realizar utilizando diferentes métodos, dependiendo de la información disponible. Los dos enfoques más comunes son el uso de entalpías de formación y energías de enlace.
- Con entalpías de formación (ΔHf):
- ΔHr = Σ ΔHf (productos) – Σ ΔHf (reactivos)
- Con energías de enlace:
- ΔHr = Σ E (enlaces rotos) – Σ E (enlaces formados)
🔔 Recordatorio importante sobre el primer principio de la termodinámica:
- La ΔHf° de los elementos puros es 0:
- ΔHf° O₂(g) = 0 kJ/mol
- ΔHf° Cl₂(g) = 0 kJ/mol
- ΔHf° Na(s) = 0 kJ/mol
- 🚨 Si no te dan ΔHºf, es porque el elemento es puro y su valor es 0.
Cómo se encuentran en la naturaleza los elementos más comunes:
- Carbono (C): Grafito (s)
- Hidrógeno (H): H₂ (g)
- Oxígeno (O): O₂ (g)
- Nitrógeno (N): N₂ (g)
- Azufre (S): S₈ (s)
- Fósforo (P): P₄ (s)
- Cloro (Cl): Cl₂ (g)
- Flúor (F): F₂ (g)
- Yodo (I): I₂ (s)
- Bromo (Br): Br₂ (l)
Variación de ΔHºr
- La ΔHºr varía según cómo esté ajustada la ecuación química. Tenlo en cuenta al realizar cálculos relacionados con el calor transferido por una cantidad específica de materia.
- Si te piden calcular ΔHºf, debes expresarla por mol de compuesto.
Calor de Combustión (ΔHºc)
La ΔHºc es el calor liberado durante una reacción de combustión (reacción con O₂), en la que típicamente se producen CO₂ y H₂O.
- Ejemplo:
- CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
- 2H₂(g) + O₂(g) → 2H₂O(g)
- 2CO(g) + O₂(g) → 2CO₂(g)
Nota: Si no hay carbono (C), no se liberará CO₂, y si no hay hidrógeno (H), no se formará H₂O.
Reacciones de Formación
Las reacciones de formación producen un mol de un compuesto a partir de sus elementos en sus estados estándar, normalmente a temperatura ambiente.
Ejemplos de reacciones de formación:
- 2 H₂(g) + O₂(g) → 2 H₂O(l)
- C(s) + O₂(g) → CO₂(g)
- ½ N₂(g) + 1½ H₂(g) → NH₃(g)
- 4 Fe(s) + 3 O₂(g) → 2 Fe₂O₃(s)
¿Quieres más práctica sobre el primer principio de la termodinámica?
Si necesitas profundizar en el tema, te invitamos a visitar este otro post donde encontrarás ejemplos de problemas de termoquímica resueltos en vídeo. Una excelente manera de aplicar lo aprendido y dominar estos conceptos.
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
Este año, como novedad, lanzamos NUESTROS EXCLUSIVOS RESÚMENES DE QUÍMICA, cuidadosamente diseñados para destacar los conceptos clave más importantes de cada tema. Estos resúmenes están disponibles por solo 8€ y son una herramienta esencial para tu aprendizaje.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Redox para PAU y PCE: Resumen, Trucos y Ajuste
Domina redox en la PAU y PCE con nuestros consejos y trucos para resolver problemas complejos y comunes en Selectividad.
Aprende a resolver problemas de estequiometría paso a paso
🧪 Cómo empezar un problema de estequiometría (sin perderte) 🌟 La guía definitiva para convertir cualquier dato en moles y resolver tus ejercicios con éxito Índice del post: 🎥 Videoclase de introducción a la estequiometría 📘 Explicación paso a paso 🧠 Infografía...
Conectores para la PAU: tipos, ejemplos y cómo mejorar tu redacción
Descubre cómo evitar errores ortográficos con palabras homófonas en la PCE 2025. Aprende las reglas clave y practica con ejercicios interactivos.
Cuentos de Emilia Pardo Bazán en la PAU 2026: cómo estudiarlos bien y no perder puntos en Lengua
Os contamos todas las novedades del nuevo modelo de Castellano de la PAU 2026. Ten en cuenta todos los cambios de este nuevo curso y preparáte para sacar la mejor nota. Para cualquier consulta, nuestro equipo docente estará encantado de ayudarte.
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!