⚛️Todo lo que necesitas saber sobre el tema de EQUILIBRIO QUÍMICO para preparar la selectividad y PCE⚗️
Resumen de equilibrio, soluciones de examen PAU y PCE, trucos para resolver problemas, errores tipo y mucho más…
¡Prepárate para la PAU y las PCE con nuestro especial sobre EQUILIBRIO QUÍMICO!
Cuando te enfrentas a un problema de equilibrio químico, lo más difícil suele ser saber por dónde empezar, especialmente si no es el típico ejercicio directo. Las dudas aparecen rápido: ¿uso Kc o Kp? ¿Qué pasa si cambian la presión o la temperatura? 😰
En este post de nuestra serie para la Selectividad de Química, descubrirás todo lo que necesitas saber para dominar el equilibrio químico. Te enseñaremos a identificar qué hacer en cada tipo de problema, desde los más simples hasta los que parecen un laberinto.
Además, te daremos trucos clave para resolver ejercicios tipo, te mostraremos los errores más comunes que debes evitar y responderemos a esas preguntas que siempre surgen cuando estás resolviendo problemas de equilibrio.
Estamos más que acostumbrados a ayudar con estas dudas y queremos que las interiorices y asimiles completamente. 🚀
¡Vamos a por ello!
⚛️¿Qué es el equilibrio químico?
El equilibrio químico ocurre cuando las reacciones directa e inversa suceden a la misma velocidad, manteniendo las concentraciones de reactivos y productos constantes en el tiempo.
📌 Claves del equilibrio químico:
- No significa que las concentraciones sean iguales, sino que se mantienen estables.
- Es un estado dinámico, los reactivos y productos siguen transformándose, pero sin cambios netos.
- Las condiciones externas (temperatura, presión, volumen) pueden afectar el equilibrio.
💡 Ejemplo de reacción en equilibrio:
\[
N_2O_4(g) \rightleftharpoons 2 NO_2(g)
\]
⚛️ Constante de equilibrio (Kc y Kp)
Para una reacción química del tipo:
\[
a A + b B \rightleftharpoons c C + d D
\]Se define la constante de equilibrio en función de concentraciones (Kc):
\[
K_c = \frac{[C]^c [D]^d}{[A]^a [B]^b}
\]
📌 Importante: En Kc no se incluyen sólidos ni líquidos puros, solo gases y sustancias disueltas en agua (acuosas).Si trabajamos con presiones parciales, usamos la constante Kp:
\[
K_p = \frac{(P_C)^c (P_D)^d}{(P_A)^a (P_B)^b}
\]Relación entre Kc y Kp:
\[
K_p = K_c (RT)^{\Delta n}
\]donde Δn es la diferencia entre los moles de gas en los productos y los reactivos.
✅ Si Δn = 0, entonces Kp = Kc.
⚛️ Cómo se modifica la constante de equilibrio (Kc)
Cuando trabajamos con reacciones químicas en equilibrio, es importante saber cómo se comporta la constante de equilibrio (Kc) si realizamos cambios en la ecuación. Aquí te dejamos las reglas clave:
- Reacción inversa: Si inviertes la reacción, la constante de equilibrio se convierte en su inverso:
\[
K’_c = \frac{1}{K_c}
\]Esto significa que si la reacción va en sentido contrario, el valor de Kc también se invierte.
- Cambio en los coeficientes estequiométricos: Si multiplicas los coeficientes de la reacción por un número n, la constante de equilibrio se eleva a la potencia de ese número:
\[
K’_c = (K_c)^n
\]Por ejemplo, si duplicas todos los coeficientes de la ecuación, entonces Kc se eleva al cuadrado.
- Reacciones combinadas (suma de equilibrios): Si combinas varias reacciones en equilibrio, la constante de equilibrio total es el producto de las constantes individuales:
\[
K»_c = K_c \cdot K’_c
\]Esto se aplica cuando sumas reacciones químicas para obtener una ecuación global.
⚛️¿Cómo saber hacia dónde se desplazará el equilibrio?
Para predecir el sentido de una reacción, se usa el cociente de reacción (Q):
- Si Q < Kc, la reacción avanza hacia la derecha (se forman más productos).
- Si Q = Kc, la reacción ya está en equilibrio.
- Si Q > Kc, la reacción avanza hacia la izquierda (se consumen productos y se forman más reactivos).
El cociente de reacción Q tiene la misma fórmula que la constante de equilibrio Kc, pero se calcula con concentraciones que no necesariamente están en equilibrio.
⚛️¿Cómo saber hacia dónde se desplazará el equilibrio?
El grado de disociación, representado por α, indica la proporción de moles iniciales que se disocian en una reacción química. Se puede expresar de varias maneras, dependiendo de si trabajamos con moles, concentraciones o presiones:
\[
\alpha = \frac{n_{\text{disociados}}}{n_{\text{inicial}}} \quad ; \quad \alpha = \frac{C_{\text{disociados}}}{C_{\text{inicial}}} \quad ; \quad \alpha = \frac{P_{\text{disociados}}}{P_{\text{total}}}
\]También se puede escribir en función de la cantidad disociada \(x\):
\[
\alpha = \frac{x}{n_{\text{inicial}}} \quad ; \quad \alpha = \frac{x}{C_{\text{inicial}}} \quad ; \quad \alpha = \frac{x}{P_{\text{total}}}
\]
¿Cómo aplicarlo en una reacción?
Consideremos la reacción:
\[
A \rightleftharpoons 2B
\]
| A | ⇌ | 2B | |
|---|---|---|---|
| C inicial | C | 0 | |
| ΔC (cambio) | \(-x = -\alpha \cdot C\) | \(2x = 2\alpha \cdot C\) | |
| C en equilibrio | \(C – \alpha \cdot C\) | \(2\alpha \cdot C\) | |
| Ejemplo | \[ N_2O_4 \rightleftharpoons 2NO_2 \] |
||
👀 Para completar la tabla, multiplica \( \alpha \cdot C \) por el coeficiente estequiométrico correspondiente.
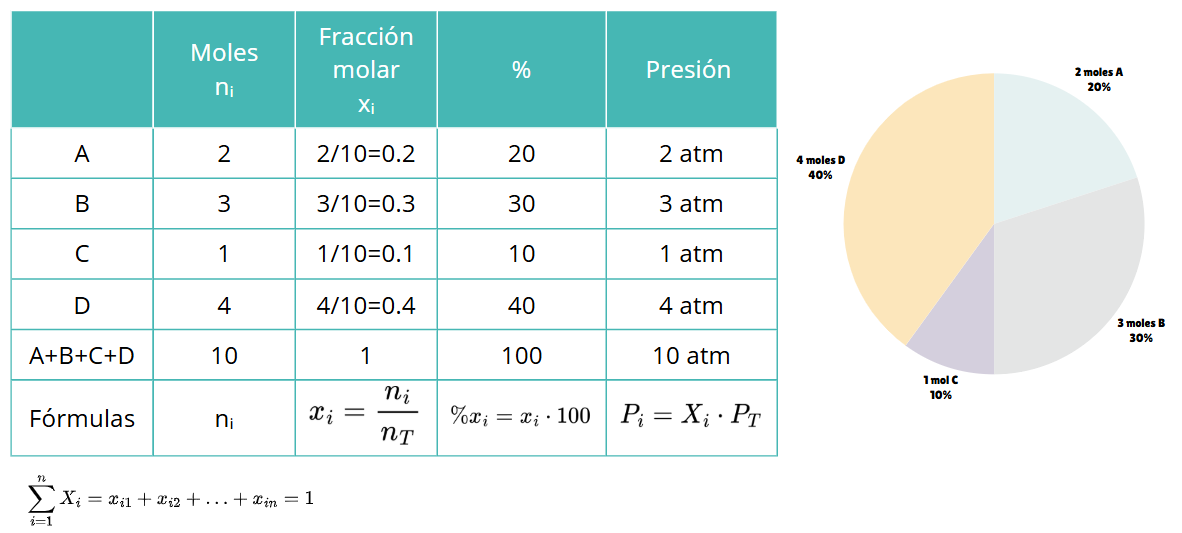
⚛️ ¿Cómo se calcula la fracción molar?
La fracción molar (\(X_i\)) de un componente se define como la proporción de moles de esa sustancia respecto al total de moles de la mezcla:
\[
X_i = \frac{n_i}{n_T}
\]Donde:
- \( n_i \) = moles de la sustancia
- \( n_T \) = moles totales de la mezcla
Además, puedes expresar la fracción molar en forma de porcentaje:
\[
\%X_i = X_i \cdot 100
\]Y si necesitas calcular la presión parcial de un gas en una mezcla, puedes usar:
\[
P_i = X_i \cdot P_T
\]Donde:
- \( P_T \) = presión total de la mezcla
⚛️ Equilibrio Heterogéneo
Las soluciones pueden clasificarse en función de la cantidad de soluto disuelto en:
- Diluidas
- Saturadas
- Sobresaturadas
En los equilibrios heterogéneos, el soluto puede encontrarse en estado sólido o disuelto, y su comportamiento se describe con la siguiente ecuación de equilibrio:
\[
A_aB_b \rightleftharpoons aA^{b+}_{\text{ac}} + bB^{a-}_{\text{ac}}
\]📌 Interpretación del equilibrio:
- Si el equilibrio se desplaza hacia la derecha, el sólido se disuelve.
- Si el equilibrio se desplaza hacia la izquierda, el soluto precipita.
🧪 Solubilidad y Producto de Solubilidad (Ks)
La solubilidad es la concentración de soluto a la cual la disolución está saturada. Cuando se alcanza esta concentración, la disolución no admite más soluto disuelto.
La constante de equilibrio para estos procesos se denomina producto de solubilidad (Ks) y se expresa como:
\[
K_{ps} = [A^{b+}]^a \cdot [B^{a-}]^b
\]
📌 Ejemplos de Sales y su Producto de Solubilidad (Ks)
1️⃣ Sales de tipo AB:
\[
\text{AgCl (s)} \rightleftharpoons \text{Ag}^+ (\text{ac}) + \text{Cl}^- (\text{ac})
\]
\[
K_s = [\text{Ag}^+] [\text{Cl}^-]
\]
\[
S = \sqrt{K_s}
\]2️⃣ Sales de tipo AB₂:
\[
\text{MgF}_2 (s) \rightleftharpoons \text{Mg}^{2+} (\text{ac}) + 2\text{F}^- (\text{ac})
\]
\[
K_s = [\text{Mg}^{2+}] [\text{F}^-]^2
\]
\[
S = \sqrt[3]{\frac{K_s}{4}}
\]3️⃣ Sales de tipo AB₃:
\[
\text{Al(OH)}_3 (s) \rightleftharpoons \text{Al}^{3+} (\text{ac}) + 3\text{OH}^- (\text{ac})
\]
\[
K_s = [\text{Al}^{3+}] [\text{OH}^-]^3
\]
\[
S = \sqrt[4]{\frac{K_s}{27}}
\]📌 Importante: Para calcular la solubilidad (S) a partir del Ks, se debe considerar el coeficiente estequiométrico del ion en la ecuación de equilibrio.
⚛️ Factores que afectan el equilibrio químico (Principio de Le Châtelier)
✔ Temperatura:
- El aumento de temperatura desplazará el equilibrio en el sentido en que la reacción absorba calor
(hacia el lado endotérmico, ΔH= +). - El descenso de temperatura lo hará en el sentido en que se desprenda calor
(hacia el lado exotérmico, ΔH= -).
✔ Presión y volumen:
- Aumentar la presión (o reducir el volumen) desplaza el equilibrio hacia el lado con menos moles gaseosos.
- Disminuir la presión (o aumentar el volumen) favorece el lado con más moles gaseosos.
- Si Δn = 0, los cambios de presión y volumen no afectan al equilibrio.
✔ Concentración:
- Aumentar la concentración de un reactivo desplaza el equilibrio hacia los productos.
- Aumentar la concentración de un producto desplaza el equilibrio hacia los reactivos.
- Es decir: ↑↓C → desplazamiento hacia el lado opuesto (solo en gases y soluciones acuosas).
✔ Catalizadores:
- No alteran el equilibrio, solo aceleran la reacción en ambos sentidos.
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Cuentos de Emilia Pardo Bazán en la PAU 2026: cómo estudiarlos bien y no perder puntos en Lengua
Os contamos todas las novedades del nuevo modelo de Castellano de la PAU 2026. Ten en cuenta todos los cambios de este nuevo curso y preparáte para sacar la mejor nota. Para cualquier consulta, nuestro equipo docente estará encantado de ayudarte.
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
📝Formulario de Matemáticas para Selectividad PAU y PCE (descarga gratuita)
Descarga nuestro formulario gratuito de Matemáticas para Selectividad PAU y PCE: todas las fórmulas e identidades resumidas en dos páginas. Ideal para repasar y mejorar tus resultados. Incluye los enlaces a nuestros cursos para que puedas prepararte con nosotras.
✨ Ejercicios de Derivadas: Evita los Errores Tontos y Domínalas (PAU, PCE, +25)
Practica las derivadas con ejercicios paso a paso y aprende a evitar los errores más comunes de PAU, PCE y +25. Esquemas visuales, trucos, ejemplos claros y tests interactivos para que entiendas las matemáticas de verdad.
📚 Modelos de examen de la Selectividad PAU 2025 y 2026: 💡 ¿Qué son las preguntas competenciales y cómo enfrentarlas?
Descubre todos los modelos de examen de la nueva selectividad PAU 2025 y 2026, actualizados por comunidades autónomas. Incluye ejemplos oficiales, preguntas competenciales y consejos para practicar con los nuevos formatos de examen.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!

