⚛️Todo lo que necesitas saber sobre el tema de CINÉTICA QUÍMICA para preparar la selectividad y PCE⚗️
Resumen de cinética, exámenes resueltos PAU y PCE, trucos, errores tipo y mucho más…
¡Prepárate para la PAU y las PCE con nuestro especial sobre CINÉTICA!
Descubre lo más importante sobre el tema de cinética química en nuestro post de la serie para la selectividad de química. Aquí te contamos exactamente lo que necesitas saber para dominar este tema. Te daremos los mejores trucos para resolver ejercicios tipo, te mostraremos los errores más comunes y responderemos a esas preguntas que siempre surgen con la cinética. Estamos más que acostumbrados a resolver estas dudas y queremos que las interiorices y asimiles completamente. ¡Vamos a por ello!
⚛️¿Qué es la cinética química?
La cinética química estudia la velocidad de las reacciones químicas y los factores que la modifican. Es un aspecto fundamental en química, ya que permite comprender cómo y por qué las reacciones ocurren a diferentes velocidades.
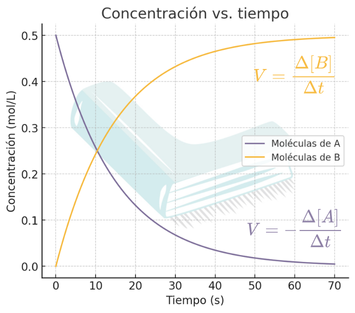
Velocidad de reacción: desaparición y aparición de sustancias
En la reacción: A →B
Los reactivos desaparecen ➝
Los productos aparecen ➝
Unidades de velocidad:
👀 Observa que la velocidad de un reactivo es negativa, ya que su concentración disminuye con el tiempo, mientras que la de un producto es positiva porque su concentración aumenta.
⚛️VELOCIDAD DE REACCIÓN
La velocidad de una reacción mide la variación de la concentración de los reactivos o productos a lo largo del tiempo. Se expresa en mol·L⁻¹·s⁻¹.
Para una reacción general:
La velocidad media se define como:
Esto indica cómo desaparecen los reactivos y aparecen los productos en un intervalo de tiempo determinado.
📌 ¿Cómo aplicar esta fórmula en los ejercicios de examen?
Te dejamos un problema resuelto de la PAU en vídeo para que veas cómo utilizarla paso a paso. 🎥 Además, al final del post encontrarás todos los ejercicios de cinética de la PAU y PCE resueltos en vídeo.
⚛️Ecuación de velocidad y orden de reacción
Para una reacción de la forma:
La ecuación de velocidad es:
Donde:
- k es la constante de velocidad, que depende de la temperatura, la energía de activación y la naturaleza de la reacción.
- n y m son los órdenes parciales de los reactivos, determinados experimentalmente.
- n + m es el orden global de la reacción.
💡 Importante: En reacciones no elementales, los órdenes no coinciden con los coeficientes estequiométricos.
⚛️ Determinación de las unidades de la constante de reacción:
Las unidades de la constante k dependen del orden de la reacción y se obtienen despejando k en la ecuación de velocidad.

⚛️Cálculo del orden de reacción
El orden de reacción se determina experimentalmente, observando cómo cambia la velocidad al modificar la concentración de un reactivo, manteniendo los demás constantes.
Ejemplo:
| Experimento | [A] (mol·L⁻¹) | [B] (mol·L⁻¹) | V (mol·L⁻¹·s⁻¹) |
|---|---|---|---|
| 1 | 0.25 | 0.25 | 0.015 |
| 2 | 0.50 | 0.25 | 0.030 |
| 3 | 0.25 | 0.50 | 0.060 |
| 4 | 0.50 | 0.50 | 0.120 |
Análisis: Comparando los experimentos 1 y 2, al duplicar [A] y mantener [B] constante, la velocidad se duplica. Esto indica que la reacción es de orden 1 respecto a [A].
En este ejercicio de selectividad resuelto aprenderás a determinar experimentalmente el orden de reacción cuando intervienen dos reactivos. 🎥⚗️
⚛️Órdenes de reacción más comunes
- Orden 0: La velocidad es independiente de la concentración del reactivo.
- Orden 1: La velocidad es directamente proporcional a la concentración de un reactivo.
- Orden 2: La velocidad es proporcional al cuadrado de la concentración de un reactivo o al producto de dos concentraciones.
- Orden 3: La velocidad es proporcional al cubo de la concentración de un reactivo o al producto de tres concentraciones.
⚛️Teoría de las colisiones
Para que una reacción ocurra, los reactivos deben chocar con la orientación adecuada y con una energía suficiente para superar la barrera de energía de activación (Ea).
Factores que afectan la velocidad de reacción
- Naturaleza de las sustancias: Gases reaccionan más rápido que líquidos y sólidos debido a la mayor movilidad de las partículas. Pulverizar sólidos también aumenta la velocidad.
- Concentración de reactivos: A mayor concentración, mayor frecuencia de colisiones efectivas.
- Temperatura: Un aumento de temperatura incrementa la energía cinética de las partículas, aumentando la velocidad de reacción. Esto se describe con la Ecuación de Arrhenius:
- Catalizadores: Disminuyen la energía de activación y aumentan la velocidad sin consumirse en la reacción.
⚛️Mecanismo de reacción
El mecanismo de reacción describe las etapas por las que transcurre una reacción química. La etapa más lenta determina la velocidad global.
📌 Ejemplo:
Para la reacción: 2𝐍𝐎(𝐠) + 𝐂𝐥₂(𝐠) → 2𝐍𝐎𝐂𝐥(𝐠)
- Etapa 1 (lenta 🐌):
- 𝐍𝐎(𝐠) + 𝐂𝐥₂(𝐠) → 𝐍𝐎𝐂𝐥₂(𝐠)
- 𝑉 = 𝑘 [𝐍𝐎][𝐂𝐥₂]
- Etapa 2 (rápida ⚡):
- 𝐍𝐎𝐂𝐥₂(𝐠) + 𝐍𝐎(𝐠) → 2𝐍𝐎𝐂𝐥(𝐠)
Conclusión:
- La ecuación de velocidad de la reacción global se determina por la etapa lenta, ya que es la que limita la rapidez del proceso. En esta etapa, los órdenes parciales coinciden con los coeficientes estequiométricos.
- Es importante recordar que la ecuación de velocidad global resulta de la suma de las etapas elementales, donde los órdenes parciales reflejan directamente los coeficientes estequiométricos de cada paso.
🧪 Modelos de Examen de Cinética Química para la PAU y PCE
¿Quieres poner a prueba tus conocimientos sobre cinética química? 💡 Una de las mejores maneras de prepararte para la Selectividad (PAU) y la PCE es practicando con exámenes reales y ejercicios similares a los que encontrarás el día de la prueba.
A continuación, te dejamos enlaces a modelos de examen que te ayudarán a familiarizarte con el formato, el tipo de preguntas y los criterios de corrección. ¡Practica y llega con seguridad al examen!
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Redox para PAU y PCE: Resumen, Trucos y Ajuste
Domina redox en la PAU y PCE con nuestros consejos y trucos para resolver problemas complejos y comunes en Selectividad.
Aprende a resolver problemas de estequiometría paso a paso
🧪 Cómo empezar un problema de estequiometría (sin perderte) 🌟 La guía definitiva para convertir cualquier dato en moles y resolver tus ejercicios con éxito Índice del post: 🎥 Videoclase de introducción a la estequiometría 📘 Explicación paso a paso 🧠 Infografía...
Conectores para la PAU: tipos, ejemplos y cómo mejorar tu redacción
Descubre cómo evitar errores ortográficos con palabras homófonas en la PCE 2025. Aprende las reglas clave y practica con ejercicios interactivos.
Cuentos de Emilia Pardo Bazán en la PAU 2026: cómo estudiarlos bien y no perder puntos en Lengua
Os contamos todas las novedades del nuevo modelo de Castellano de la PAU 2026. Ten en cuenta todos los cambios de este nuevo curso y preparáte para sacar la mejor nota. Para cualquier consulta, nuestro equipo docente estará encantado de ayudarte.
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!

