⚛️Todo lo que necesitas saber sobre el tema de ÁCIDO BASE para preparar la selectividad y PCE⚗️
Resumen de ácido-base, soluciones de examen PAU y PCE, trucos para resolver problemas, errores tipo y mucho más…
¡Ácido-Base (transferencia de protones): Lo que tienes que tener clarísimo para la PAU/PCE!
Cuando te enfrentas a un problema de ácido-base, lo más complicado suele ser saber cómo encajarlo: ¿estoy ante una disolución ácida o básica?, ¿es un ácido fuerte o débil?, ¿hidroliza o no hidroliza?, ¿qué son las sales?, ¿uso el pH o la Ka? 😵💫
En este post de nuestra serie para la Selectividad de Química, vas a encontrar todo lo que necesitas para entender y resolver problemas de ácido-base sin perderte en el intento. Te ayudaremos a reconocer fácilmente si estás ante un ácido, una base o una sal, a aplicar la fórmula adecuada en cada situación y a esquivar esos errores típicos que suelen costar puntos valiosos en el examen.
También repasaremos conceptos como pKa, Kw o hidrólisis de sales con ejemplos clave, te daremos trucos que funcionan en el examen y te ayudaremos a ver con claridad qué hacer en cada tipo de ejercicio.
Llevamos años viendo cómo este tema se atraganta y por eso queremos que lo veas claro de una vez por todas. Y si puedes entenderlo sin memorizar como un robot, mucho mejor. 💥
¡Vamos a por ello!
⚛️¿Qué es un ácido? ¿y una base?
1. Teoría de Arrhenius (la más clásica)
-
-
Ácido: sustancia que libera H⁺ (protones) en disolución acuosa.
-
Base: sustancia que libera OH⁻ (iones hidroxilo) en disolución acuosa.
-
✅ Ejemplo:
-
-
Ácido → HCl → H⁺ + Cl⁻
-
Base → NaOH → Na⁺ + OH⁻
-
❗ Limitación: solo funciona en disoluciones acuosas y no explica sustancias como el amoníaco (NH₃), que es una base pero no tiene OH⁻.
2. Teoría de Brønsted-Lowry (más general)
-
Ácido: sustancia que dona un protón (H⁺).
-
Base: sustancia que acepta un protón (H⁺).
✅ Ejemplo: HCl + H₂O → Cl⁻ + H₃O⁺
- HCl es el ácido (cede H⁺), H₂O es la base (acepta H⁺)
🧠 Esta teoría explica muchos más casos e incluye en concepto de ácido/base conjugada.
3. Teoría de Lewis (la más amplia)
-
Ácido: sustancia que acepta un par de electrones.
-
Base: sustancia que cede un par de electrones.
✅ Ejemplo: NH₃ + BF₃ → F₃B←NH₃
- NH₃ es la base (cede un par de e⁻), BF₃ es el ácido (los acepta)
💡 Esta definición incluye reacciones sin H⁺, como muchas reacciones orgánicas y complejos metálicos.
⚛️Pares ácido/base conjugados
Para que exista un ácido que cede protones debe haber una base que los capte.
Cuando una sustancia actúa como ácido o base, siempre forma lo que se llama su par conjugado:
- Si un ácido pierde un H⁺, se convierte en su base conjugada.
- Si una base gana un H⁺, se convierte en su ácido conjugado.
Ácido 1 + Base 2 ⇌ Base conjugada 1 + Ácido conjugado 2
HCl + H₂O → Cl⁻ + H₃O⁺
Par ácido/base conjugada: HCl / Cl⁻
Par base/ ácido conjugado: H₂O / H₃O⁺
⚛️¿Qué es un ácido, una base y una sal?
Un quebradero de cabeza que tienen muchos de nuestros/as estudiantes es no saber identificar bien los ácidos, las bases y las sales cuando se los encuentran en un ejercicio. Y lo entendemos: a veces se parecen, otras veces cambian según el contexto… 😵💫
En este vídeo corto te lo explicamos de forma clara y directa, para que te quede súper claro de una vez por todas. Pulsa play y verás que no era tan complicado.
⚛️Ácidos y bases fuertes: ¡apréndetelos!
Aquí tienes una lista de los ácidos y bases fuertes más comunes, los que más suelen aparecer en los exámenes.
🎯 ¿Tienes que aprendértelos de memoria? Lo más recomendable es que sí, así no te pillan por sorpresa. Pero hay un truco: si en un problema no te dan ni te piden la Ka o la Kb, es porque esa sustancia es fuerte y se disocia completamente.
➡️ En ese caso, no hay equilibrio, y la flecha va solo en un sentido (→), ¡eso te da una pista clave!
⚛️Ácidos y bases débiles
A diferencia de los fuertes, los ácidos y bases débiles no se disocian completamente, sino parcialmente, y eso lo cambia todo: aquí sí se forma un equilibrio (⇌) y sí entra en juego la Ka o la Kb.

Por eso, si en un ejercicio te dan (o te piden) la Ka o la Kb… ya sabes que estás ante una sustancia débil.
🧪 Ejemplos típicos que debes reconocer como débiles:
- Ácidos débiles: HF, CH₃COOH (ácido acético), H₂CO₃…
- Bases débiles: NH₃, CH₃NH₂, aniones de ácidos débiles como F⁻ o CN⁻…
⚛️ Producto iónico del agua y pH
Una parte clave del tema ácido-base es entender bien el producto iónico del agua (Kw). Apúntate esta fórmula porque es fundamental para cualquier ejercicio de pH y pOH:
🧪 Kw = [H₃O⁺] · [OH⁻] = 10⁻¹⁴ (a 25 ºC)
Esto te permite saber si una disolución es:
🟢 Neutra: [H₃O⁺] = [OH⁻] = 10⁻⁷ M
🔴 Ácida: [H₃O⁺] > 10⁻⁷ M y [OH⁻] < 10⁻⁷ M
🔵 Básica: [H₃O⁺] < 10⁻⁷ M y [OH⁻] > 10⁻⁷ M
Este equilibrio está siempre presente en agua, aunque no lo veas. Por eso, si conoces una de las concentraciones, puedes calcular la otra usando Kw.
⚛️ ¿Qué son el pH y el pOH?
El pH y el pOH son formas de expresar cuán ácida o básica es una disolución, pero en vez de trabajar con concentraciones pequeñísimas (como 10⁻⁵ M, 10⁻⁸ M…), usamos una escala logarítmica mucho más manejable.
- El pH mide la concentración de iones H₃O⁺ (protones) en la disolución.
- El pOH mide la concentración de iones OH⁻ (hidroxilo).
🧪 Cuanto más bajo es el pH, más ácida es la disolución.
🧪 Cuanto más bajo es el pOH, más básica es.
Las fórmulas para calcularlos son:
- pH = –log [H₃O⁺]
- pOH = –log [OH⁻]
Y sus inversas:
- [H₃O⁺] = 10⁻ᵖᴴ
- [OH⁻] = 10⁻ᵖᴼᴴ
- Y por si lo olvidabas…
pH + pOH = 14
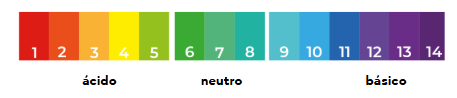
⚛️ Escala de pH
- pH= 7 solución neutra
- pH < 7 solución ácida
- pH > 7 solución básica
⚛️ Constantes de acidez y de basicidad
Cuando trabajamos con ácidos y bases débiles, su disociación no es total, así que necesitamos una forma de medir cuánto se disocian. Ahí es donde entran las constantes Ka y Kb:
-
Ka (constante de acidez) mide cuánto se disocia un ácido débil en equilibrio.
-
Kb (constante de basicidad) hace lo mismo, pero para una base débil.
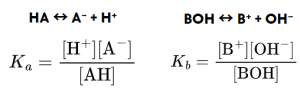
👀 Observa que cuanto más desplazado hacia la derecha este el equilibrio más grande serán Ka y Kb. Es decir a mayor Ka mayor fortaleza del ácido y a mayor Kb mayor fortaleza de la base.
⚛️ ¿Qué son pKa y pKb?
Las constantes Ka y Kb nos indican la fuerza de un ácido o una base débil, pero al igual que ocurre con las concentraciones en el pH, los valores suelen ser muy pequeños (como 10⁻⁵, 10⁻⁸, etc.). Por eso, en lugar de trabajar con esos números tan incómodos, usamos su versión logarítmica:
- pKa = –log Ka
- pKb = –log Kb
También podemos trabajar con sus inversas y obtener el valor de Ka y Kb si nos dan las pK.
- Ka = 10⁻ᵖᴷᵃ
- Kb = 10⁻ᵖᴷᵇ
Importante:
👀 Observa que cuanto mayor es el valor de pKa o pKb menor es la fuerza del ácido o de la base.
👀 La relaciónKa⋅Kb=Kw implica que a un mayor valor de Ka, correspondiente a un ácido relativamente fuerte, le sigue un menor Kb para su base conjugada, señalando una base débil. Inversamente, ácidos débiles se asocian a bases conjugadas fuertes. Este principio es recíproco para bases y sus ácidos conjugados.
Además, recuerda que se relacionan con el agua y el equilibrio ácido-base:
-
Ka · Kb = 10⁻¹⁴
-
pKa + pKb = 14
⚛️ Hidrólisis de sales: ¿neutras, ácidas o básicas?
Cuando un ácido reacciona con una base, se forma una sal. Pero no todas las sales son neutras. Algunas pueden alterar el pH del medio, dependiendo del tipo de ácido y base que les dio origen.
Aquí tienes la guía definitiva para no confundirte:
| Procedencia | Tipo de sal | ¿Hidrólisis? | pH de la disolución | Ejemplo |
|---|---|---|---|---|
| Ácido fuerte + Base fuerte | Sal neutra | ❌ No | ≈ 7 (neutro) | NaCl |
| Ácido fuerte + Base débil | Sal ácida | ✅ Sí | < 7 (ácido) | NH₄Cl |
| Ácido débil + Base fuerte | Sal básica | ✅ Sí | > 7 (básico) | NaCN |
| Ácido débil + Base débil | Depende | ✅ Sí | Depende del Ka y Kb | NH₄CN |
👀 Ten en cuenta que la especie que se hidroliza es la débil:
- NH₄⁺ + H₂O ↔ NH₃ + H₃O⁺ (pH ácido)
- CN⁻ + H₂O ↔ HCN + OH⁻ (pH básico)
⚛️ Neutralización: ácido + base → sal + agua
La reacción típica entre un ácido y una base da lugar a una sal y, en la mayoría de los casos, agua.
🧪 La fórmula general es: ÁCIDO + BASE → SAL + AGUA
Pero ¡ojo!, para que se forme agua, debe haber oxígeno en la base (normalmente como OH⁻). Si la base no tiene oxígeno, como el NH₃, no se forma agua, aunque sí se forme sal.
Ejemplos típicos que debes reconocer:
✅ HCl + NaOH → NaCl + H₂O
✅ 2 HCl + Ca(OH)₂ → CaCl₂ + 2 H₂O
✅ CH₃COOH + NaOH → CH₃COONa + H₂O
❌ HCl + NH₃ → NH₄Cl (no se forma agua)
✅ 2 CH₃COOH + Ca(OH)₂ → (CH₃COO)₂Ca + 2 H₂O
✅ 3 HCl + Al(OH)₃ → AlCl₃ + 3 H₂O
👀 Fíjate bien en la proporción de moles (¡no siempre es 1:1!) y en si se forma agua o no.
👀 Y no olvides que la naturaleza de la sal final puede influir en el pH, incluso si los moles estaban en proporciones exactas.
👀 En las volumetrías es muy impotante que tengas en cuenta el volumen total a la hora de hacer cálculos, que será la suma del volumen del ácido y el de la base.
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Cuentos de Emilia Pardo Bazán en la PAU 2026: cómo estudiarlos bien y no perder puntos en Lengua
Os contamos todas las novedades del nuevo modelo de Castellano de la PAU 2026. Ten en cuenta todos los cambios de este nuevo curso y preparáte para sacar la mejor nota. Para cualquier consulta, nuestro equipo docente estará encantado de ayudarte.
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
📝Formulario de Matemáticas para Selectividad PAU y PCE (descarga gratuita)
Descarga nuestro formulario gratuito de Matemáticas para Selectividad PAU y PCE: todas las fórmulas e identidades resumidas en dos páginas. Ideal para repasar y mejorar tus resultados. Incluye los enlaces a nuestros cursos para que puedas prepararte con nosotras.
✨ Ejercicios de Derivadas: Evita los Errores Tontos y Domínalas (PAU, PCE, +25)
Practica las derivadas con ejercicios paso a paso y aprende a evitar los errores más comunes de PAU, PCE y +25. Esquemas visuales, trucos, ejemplos claros y tests interactivos para que entiendas las matemáticas de verdad.
📚 Modelos de examen de la Selectividad PAU 2025 y 2026: 💡 ¿Qué son las preguntas competenciales y cómo enfrentarlas?
Descubre todos los modelos de examen de la nueva selectividad PAU 2025 y 2026, actualizados por comunidades autónomas. Incluye ejemplos oficiales, preguntas competenciales y consejos para practicar con los nuevos formatos de examen.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!

