Aprende a ajustar reacciones químicas sin miedo
Aprende con explicaciones claras y ejercicios interactivos pensados para ayudarte de verdad
🧪 A veces pensáis que la química es complicada… pero en realidad es muchísimo más sencilla de lo que parece
Muchas veces os acercáis a la química como si fuera un monstruo lleno de números raros, símbolos extraños y fórmulas imposibles.
Pero te voy a contar un secreto de profe:
👉 La química es, literalmente, desmontar cosas y volver a construirlas.
Así de simple.
Vamos a demostrártelo con Playmobil… y con Mr. Potato 😏.
🪑 La mesa de Playmobil: tu primera “reacción química”
Imagina una mesa de Playmobil. Para montarla necesitas:
-
1 tablero (T)
-
4 patas (P)
Si lo pensamos como una reacción, sería: 1T + 4P → 1TP₄
Si quieres montar dos mesas, ¿qué haces?
Pues duplicas las piezas: 2T + 8P → 2TP₄
📌 IMPORTANTE:
-
No puedes cambiar el 4 de las patas (ese es su subíndice). Las mesas típicas se construyen así, si lo cambias, dejas de tener una mesa, tendrías otra cosa.
-
Lo que sí puedes cambiar es el coeficiente (cuántas mesas montas).
Eso que haces sin pensar al montar una mesa… es exactamente lo que hacemos en química al ajustar una reacción.
🥔 Mr. Potato: desmontar, mezclar y volver a construir
Mr. Potato tiene piezas básicas:
-
cuerpo (C)
-
ojos (O)
-
orejas (E)
-
boca (B)
Puedes combinarlo de mil formas, pero no puedes inventarte piezas nuevas.
Lo desmontas, reorganizas sus partes… y listo.
La reacción sería: 1C + 2O + 1B + 2E → CO₂BE₂
En química pasa lo mismo:
🧩 los átomos son piezas,
🧩 las moléculas son combinaciones,
🧩 y ajustar reacciones es montar “el nuevo juguete” con las mismas piezas.
Nada más. Ni nada menos.
🔍 ¿Y qué tiene que ver esto con ajustar reacciones químicas?
TODO.
Ajustar una reacción NO es hacer operaciones raras.
Es comprobar que nada se pierde y nada aparece por arte de magia: los átomos que tienes a la izquierda (los reactivos) deben volver a aparecer, reorganizados, en la derecha (los productos).
La química no es magia:
👉 solo cambiamos cómo se combinan las piezas, nunca las piezas en sí.
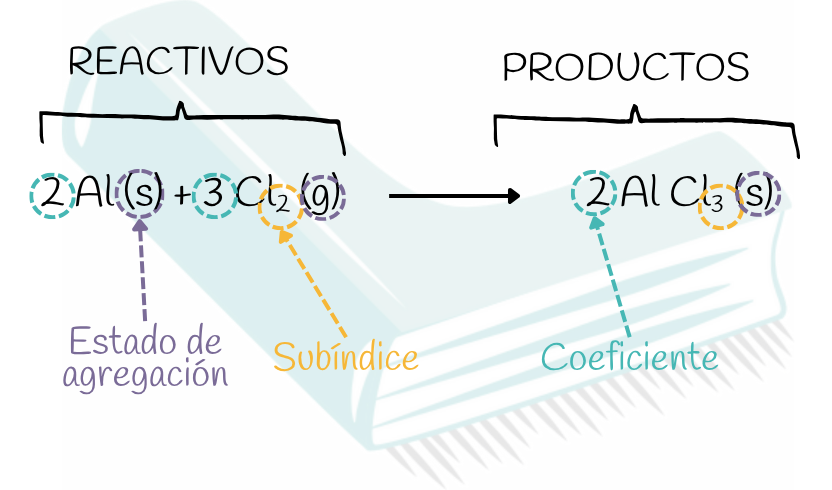
🧪Qué puedes y qué NO puedes cambiar en una reacción
Primero veamos qué es cada “cosa”, porque si entiendes bien las piezas, ajustar reacciones se vuelve mucho más sencillo.
-
Coeficiente → es el número grande que va delante de la fórmula, por ejemplo en 2H₂O o 3AlCl₃.
Te dice cuántas “unidades completas” tienes de esa sustancia (2 moléculas de agua, 3 unidades de cloruro de aluminio…).
👉 Esto SÍ lo puedes cambiar para ajustar la reacción. -
Subíndice → es el numerito pequeño que va pegado a un átomo, como el ₂ de H₂, el ₃ de AlCl₃ o el ₂ de CO₂.
Te dice cuántos átomos de ese tipo hay dentro de una molécula.
👉 Esto NO lo puedes cambiar, porque forma parte de la identidad de la sustancia. Cambiar el subíndice sería inventarte otra cosa distinta. -
Estado de agregación → son las letras entre paréntesis: (s), (l), (g), (aq).
Nos cuentan si la sustancia está en sólido, líquido, gas o disuelta en agua, pero no sirven para ajustar nada.
👉 No se tocan para ajustar, solo informan.
Una vez tienes claro qué es cada pieza (coeficiente, subíndice y estado), ya puedes jugar a “montar y desmontar” reacciones sin miedo ✨.
🔢 Cómo se ajusta una reacción química paso a paso
Igual que antes hemos montado mesas y bocadillos, ahora vamos a “montar” bien una reacción real.
Tomamos como ejemplo la combustión del propano:
Ecuación sin ajustar: C₃H₈ + O₂ → H₂O + CO₂
Nuestro objetivo es conseguir que haya el mismo número de átomos de cada elemento a la izquierda (reactivos) y a la derecha (productos).
1️⃣ Paso 1: balancea el carbono (C)
En C₃H₈ hay 3 átomos de carbono.
En el lado de los productos, el carbono está en CO₂ (1 átomo de C por molécula).
Para tener 3 carbonos en los productos, ponemos un 3 delante de CO₂:
C₃H₈ + O₂ → H₂O + 3CO₂
Ahora:
-
Izquierda: 3 C
-
Derecha: 3 C
✅ ¡Carbono balanceado!
2️⃣ Paso 2: balancea el hidrógeno (H)
En C₃H₈ hay 8 hidrógenos.
En el lado de los productos, el H está en H₂O (2 H por molécula).
¿Qué coeficiente necesitamos delante de H₂O para tener 8 H en total?
4 moléculas de agua: 4 × 2 = 8 H.
C₃H₈ + O₂ → 4H₂O + 3CO₂
Ahora:
-
Izquierda: 8 H
-
Derecha: 8 H
✅ Hidrógeno balanceado.
3️⃣ Paso 3: balancea el oxígeno (O) al final
Ahora miramos solo el oxígeno.
En el lado derecho tenemos:
-
En 4H₂O → 4×1 = 4 átomos de O
-
En 3CO₂ → 3×2 = 6 átomos de O
Total oxígenos a la derecha = 4 + 6 = 10 O.
En el lado izquierdo, el oxígeno solo está en O₂ (2 átomos de O por molécula).
¿Qué coeficiente necesitamos delante de O₂ para tener 10 O?
5 moléculas: 5×2 = 10.
Resultado:
C₃H₈ + 5O₂ → 4H₂O + 3CO₂
Ahora:
-
O a la izquierda: 5×2 = 10
-
O a la derecha: 10
✅ Oxígeno balanceado.
✅ Ecuación completamente ajustada.
🧠 ¿Por qué dejamos O₂ para el final?
Esta es la idea importante que quieres remarcar en el post:
-
El oxígeno está solo en O₂ en el lado de los reactivos.
-
Pero en los productos aparece repartido en varias moléculas (H₂O y CO₂ en este ejemplo).
Si intentáramos ajustar primero O₂, estaríamos cambiando continuamente el número de oxígenos mientras todavía no hemos decidido cuántas moléculas de CO₂ y H₂O necesitamos para el C y el H.
Sería como ajustar primero las patas de la mesa sin saber cuántas mesas vas a montar.
👉 Por eso, la estrategia habitual es:
- Primero ajustar los elementos que aparecen en menos compuestos (por ejemplo, C y H).
- Dejar para el final las moléculas simples como O₂, H₂, N₂, que solo contienen un elemento.
Así, cuando ya sabes cuántos oxígenos necesitas en total, solo tienes que ajustar el coeficiente de O₂ y listo.
🔥 ¿Y qué pasa si me sale un número impar?
Vamos a verlo con la combustión del butano: C₄H₁₀ + O₂ → CO₂ + H₂O
Primero ajustamos C y H:
-
Carbono: en C₄H₁₀ hay 4 átomos de carbono, así que ponemos 4CO₂.
C₄H₁₀ + O₂ → 4CO₂ + H₂O -
Hidrógeno: en C₄H₁₀ hay 10 hidrógenos, así que necesitamos 5H₂O (porque 5×2 = 10).
C₄H₁₀ + O₂ → 4CO₂ + 5H₂O
Ahora contamos los oxígenos en los productos:
-
En 4CO₂ hay 4×2 = 8 oxígenos
-
En 5H₂O hay 5×1 = 5 oxígenos
En total son 8 + 5 = 13 oxígenos.
Y aquí aparece la duda típica:
“Profe, ¿qué pasa si al contar oxígenos me sale un número impar?”
El oxígeno llega en O₂, es decir, en parejas.
Para conseguir un número impar de oxígenos (como 13), necesitamos usar una fracción:
C₄H₁₀ + ¹³⁄₂O₂ → 4CO₂ + 5H₂O
Ponemos ¹³⁄₂ delante de O₂ porque ¹³⁄₂ × 2 = 13.
Esta fracción es solo provisional.
En caso de que en la ecuación final no queramos fracciones, hacemos algo muy simple: multiplicamos todos los coeficientes por 2:
2C₄H₁₀ + 13O₂ → 8CO₂ + 10H₂O
Y ya está.
Si en el balance te sale un número impar de oxígenos, no te has equivocado: simplemente usa una fracción para cuadrarlo y luego multiplica toda la ecuación para dejar coeficientes enteros.
🎮 Ahora te toca a ti: juega con las reacciones
Hasta aquí te hemos contado cómo funciona esto de ajustar reacciones químicas: hemos montado mesas de Playmobil, hemos desmontado a Mr. Potato y hemos visto paso a paso cómo se ajustan combustiones reales.
Ahora llega la parte importante: practicar.
💜 Para acabar: aprender química es mucho más fácil si te acompañan bien
Si has llegado hasta aquí, enhorabuena.
Has desmontado mesas, has construido bocadillos, has equilibrado combustiones… y, sobre todo, has entendido que la química no es memorizar fórmulas, sino saber jugar con las piezas.
En La Llibreta creemos profundamente en eso:
en explicarte la ciencia de forma clara, lógica, con ejemplos que puedas imaginar y recordar, y con actividades que te permitan equivocarte, aprender y volver a intentarlo.
Si te ha gustado esta forma de aprender y quieres dar un paso más, puedes:
✨ Conseguir nuestros materiales completos, con teoría cuidada, ejercicios paso a paso, esquemas visuales y exámenes resueltos.
✨ Apuntarte a nuestros cursos, donde te acompañamos desde cero hasta dominar los contenidos de Selectividad, PCE o Grado Superior.
✨ O simplemente seguir practicando con nuestras actividades gratuitas, que ya es un gran comienzo.
Nos encantará ayudarte a que la química —y cualquier asignatura— deje de darte miedo y se convierta en algo que entiendes, controlas y hasta disfrutas.
Cuando tú quieras, seguimos aprendiendo junt@s 💜
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles desde 20€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Ejercicios de Estequiometría: Test Online para Entender Moles, RL y Disoluciones
🧪 Ejercicios de Estequiometría para Pensar (y Entender de Verdad la Química) 🌟 Practica la estequiometría con ejercicios autocorregibles, explicaciones claras y tests diseñados para que aprendas razonandoEste post no es solo teoría: es un campo de prácticas de...
Problemas de ácido base en PAU y PCE que tienes que saber resolver
Si te preparas para la PAU o la PCE, estos problemas de ácido base son imprescindibles. Descubre errores tipo y saca un 10.
Ácido-Base para PAU y PCE: Resumen, Trucos y Problemas Resueltos
Domina el equilibrio químico PAU PCE con nuestros consejos y trucos para resolver problemas complejos y comunes en Selectividad.
Equilibrio Químico para PAU y PCE: Resumen, Trucos y Problemas Resueltos
Domina el equilibrio químico PAU PCE con nuestros consejos y trucos para resolver problemas complejos y comunes en Selectividad.
Problemas de equilibrio químico en PAU y PCE que debes saber resolver
Si te preparas para la PAU o la PCE, estos problemas de equilibrio químico son imprescindibles. Descubre errores tipo y saca un 10.
Tabla de Iones Comunes y Trucos para Disociar Compuestos Químicos en Selectividad
Descubre la tabla de iones comunes y cómo se disociación los compuestos químicos para resolver ejercicios de selectividad.
⚗️Cinética Química para Selectividad y PCE – Resumen y Ejercicios Resueltos
Te contamos los aspectos claves del tema de estructura de la materia para el examen de selectividad de la Comunidad Valenciana y la PCE.
⚗️Primer Principio de la Termodinámica explicado: Termoquímica y recursos clave
Descubre el Primer Principio de la Termodinámica de forma clara y sencilla. Aprende sobre calor, trabajo, energía interna y más con ejemplos prácticos y recursos únicos.
Cómo aprobar un examen Tipo Test en las PCE Selectividad
¿Estás preparando las PCE y te enfrentas a exámenes tipo test? En este artículo encontrarás estrategias efectivas, consejos clave y recursos gratuitos para que practiques al máximo. Además, te ofrecemos cursos y materiales exclusivos que harán que tu preparación sea más completa. ¡Inscríbete y supera las PCE con éxito!
Curso GRATIS de Conceptos Básicos de Química para PAU, PCE y Pruebas de Acceso
Curso GRATIS de Química: Aprende conceptos básicos como átomos, moléculas y moles. Ideal para estudiantes sin base de química. ¡Empieza ahora!
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.