⚛️Todo lo que necesitas saber sobre el tema de ESTRUCTURA DE LA MATERIA para preparar la selectividad y PCE⚗️
¡Prepárate para la EBAU y las PCE con nuestro especial sobre Estructura Atómica!
Descubre los conceptos esenciales de la estructura atómica en el primer post de nuestra serie de artículos sobre la selectividad de química. Te ofrecemos un resumen descargable que condensa los aspectos clave del tema, además de consejos expertos para afrontar preguntas frecuentes, complejidades y errores comunes en los exámenes. Aprovecha años de experiencia docente condensados en consejos prácticos que te ayudarán a evitar los errores típicos y a enfocarte en lo crucial. ¡No te pierdas este recurso valioso para maximizar tu preparación!
⚛️¿Qué me pueden preguntar del tema de estructura de la materia?
🧪Sobre configuración electrónica y tabla periódica
Preguntas comunes para la PAU y PCE
- Deducir el número atómico Z, el número másico A, el número de protones y electrones y saber representarlo.
 A: nºmásico; Z: nºatómico; Q: carga
A: nºmásico; Z: nºatómico; Q: carga - Calcular la masa relativa de un átomo a partir de las abundancias de sus isótopos o viceversa.

- Escribir la Configuración Electrónica de Elementos Neutros e Iónicos: Ejemplo: Escribe la configuración electrónica para el Na⁺ y el F⁻.
- Na⁺: Ha perdido un electrón, su configuración es 1s² 2s² 2p⁶.
- F⁻: Ha ganado un electrón, su configuración es 1s² 2s² 2p⁶.
- Identificación de la Capa de Valencia: Ejemplo: Señala la capa de valencia en la configuración 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰.
Respuesta: La capa de valencia es 4s². La marca el número cuántico mayor. - Determinación de Periodo y Grupo de elementos representativos. Ejemplo: Indica el periodo y grupo de un elemento con la configuración electrónica 1s² 2s² 2p⁶.
- Periodo: Determinado por el número cuántico principal más alto, en este caso, n=2 (segundo periodo).
- Grupo: Dado que la configuración termina en 2p⁶, el elemento es un gas noble en el grupo 18.
- Truco:
- s¹: grupo 1
- s²: grupo 2
- A partir del p se suman 10 por las columnas de los elementos de transición. Por ejemplo sp¹: grupo 13 (2+10)
- Truco:
- Propiedades químicas similares: los elementos que pertenecen a un mismo grupo por tener la misma capa de valencia y reactividad similar. Por ejemplo, F, Cl, Br, I (halógenos).
- Metales vs. No Metales: Ejemplo: Deducir si son metales o no metales por su posición en la tabla periódica.
- Deducir la configuración electrónica de átomos excitados.
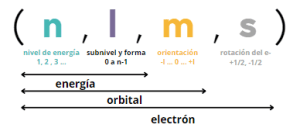
🧪Sobre Números cuánticos
Preguntas comunes para la PAU y PCE
- Saber escribir el conjunto de números cuánticos de un electrón determinado aplicando cuando sea necesario la regla de máxima multiplicidad de Hund y exclusión de Pauli. Es decir, que los electrones situados en orbitales de la misma energía tienden a situarse lo más desapareados que sea posible y que no existe ningún electrón dentro de un mismo átomo con los . Por ejemplo: el conjunto de números cuánticos para el último electrón del átomo de oxígeno sería (2, 1, -1, -1/2).
- Concer el significado y los posibles valores de los los números cuánticos.
- Decir si son o no válidos un conjunto de valores de números cuánticos y razonar porque. 👀Ojo con preguntas tipo de valores de números cuánticos teóricamente posibles pero que se refieren a un electrón de un átomo en su estado fundamental del periodo 2 y la notación es (3,0,0,+1/2). No sería posible por el 3 ya que se encuentra en el segundo periodo.
- Cálular el número de orbitales por subnivel (2l+1) o nivel n².
- Calcular el número de electrones que caben por subnivel (2l+1) y nivel (2n²).
🧪Sobre Propiedades periódicas
Preguntas comunes para la PCE (en la CV no entran propiedades periódicas)
✏️Posibles preguntas sobre RADIO ATÓMICO:
- Ordenar elementos en orden creciente o decreciente de su radio atómico.
- Comparación del ión con respecto al átomo neutro:
- Anión > neutro: Cl⁻ es mayor que Cl debido a la expansión de la nube electrónica.
- Catión < neutro: Na⁺ es menor que Na debido a una mayor atracción (al haber menos electrones y el mismo número de protones), lo que contrae el átomo.
- Comparar tamaños de elementos isoelectrónicos (misma configuración electrónica). Por ejemplo: Mg²⁺ < Na⁺ < F⁻ < O²⁻. A mayor número atómico (Z), menor tamaño.
✏️Posibles preguntas sobre ENERGÍA DE IONIZACIÓN:
- Ordenar elementos en orden de su primera Energía de Ionización (EI).
- Nota: excepciones en el segundo y tercer periodo, los átomos con orbitales s² y sp³ son más estables que aquellos con orbitales sp² y sp⁴.
- El ion más probable de un átomo, por ejemplo, Calcio (Ca): Ca²⁺.
- Estados de oxidación más probables de un elemento, como Oxígeno (O): -2.
- Comparar la primera EI con las sucesivas: las energías de ionización sucesivas aumentan, ya que al ion con carga positiva le cuesta más energía arrancar los electrones restantes.
✏️Posibles preguntas sobre AFINIDAD ELECTRÓNICA:
- Ordenarlos en orden creciente o decreciente de su 1ª EA. 👀¡Ojo no se tiene en cuenta a los gases nobles ya que no captan electrones!👀
✏️Posibles preguntas sobre ELECTRONEGATIVIDAD:
- Ordenarlos en orden creciente o decreciente de su EN. 👀¡Ojo no se tiene en cuenta a los gases nobles ya que no forman enlaces con otros átomos!👀
- Ordenar moléculas por mayor polaridad de enlace, por ejemplo: N-N < N-O < N-F.
🧪 PREGUNTAS DE QUÍMICA ESPECÍFICAS PCE
Como sabéis el examen de química de PCE consta de preguntas tipo test y un apartado de preguntas abiertas. Si todavía no conoces el modelo de examen puede verlo aquí: guía completa sobre el examen de química de la PCE.
En el apartado de preguntas tipo test suelen aparecer también preguntas teóricas, por lo que es importante que domines cuestiones como:
- La radiación electromagnética
- Hipótesis de Planck
- Efecto fotoeléctrico
- Espectros atómicos
- Modelo atómico de Bohr
- Hipótesis de Broglie
- Principio de incertidumbre
No son cuestiones muy complejas, pero sí que es importante que entiendas estos puntos y practiques con modelos de exámenes reales.
🧪 PRÉPARATE EN LA LLIBRETA
En La Llibreta, ofrecemos una variedad de cursos que se adaptan a tus necesidades, tanto en formato presencial como online. Además de nuestras clases en directo, contamos con cursos online en diferido que incluyen video clases detalladas, exámenes resueltos, resúmenes, y cuestionarios autocorregibles, entre otros recursos. También tienes la opción de comprar solo el material didáctico, sin incluir las videoclases.
Este año, como novedad, lanzamos NUESTROS EXCLUSIVOS RESÚMENES DE QUÍMICA, cuidadosamente diseñados para destacar los conceptos clave más importantes de cada tema. Estos resúmenes están disponibles por solo 8€ y son una herramienta esencial para tu aprendizaje.
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Matrícula abierta 2025-2026
Últimas plazas para nuestro curso anual
Matrícula abierta 2025-2026
¡Ultimísimas plazas para el curso anual PAU 2026!
Prepárate en la Llibreta
Prepárate con nuestroscursos híbridos. Podrás asistir de manera presencial u online. ¡Además las clases se quedan grabadas!
Compra nuestros apuntes
Tienes nuestros apuntes, esquemas, resúmens, glosarios y mucho más disponibles por 40€ y el curso de videomaterial por 190€.
Exámenes de química
Todos los exámenes de Química RESUELTOS de la EVAU, PCE, PAU+25 y PAGS
Más recursos de química
Calculadora de notas
Utiliza nuestro simulador de notas y descubre cuál es tu objetivo para que te alcance la nota de corte.
También te puede interesar
Podcast de Biología para selectividad– Episodio 5: Las enzimas
🎧Biología Selectividad: las ENZIMAS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 5: Las ENZIMAS En Academia La Llibreta no paramos! Después del éxito de nuestros últimos episodios seguimos...
Podcast de Biología para selectividad– Episodio 6: Los ácidos nucleicos
🎧Biología Selectividad: los ÁCIDOS NUCLEICOS en Podcast Para que aprendas mientras haces otras cosas 🎧 Novedad: estrenamos podcast de Biología para PAU y PCE — Episodio 6: Los ÁCIDOS NUCLEICOS En Academia La Llibreta no paramos! Después del éxito de nuestros dos...
📝Formulario de Matemáticas para Selectividad PAU y PCE (descarga gratuita)
Descarga nuestro formulario gratuito de Matemáticas para Selectividad PAU y PCE: todas las fórmulas e identidades resumidas en dos páginas. Ideal para repasar y mejorar tus resultados. Incluye los enlaces a nuestros cursos para que puedas prepararte con nosotras.
✨ Ejercicios de Derivadas: Evita los Errores Tontos y Domínalas (PAU, PCE, +25)
Practica las derivadas con ejercicios paso a paso y aprende a evitar los errores más comunes de PAU, PCE y +25. Esquemas visuales, trucos, ejemplos claros y tests interactivos para que entiendas las matemáticas de verdad.
📚 Modelos de examen de la Selectividad PAU 2025 y 2026: 💡 ¿Qué son las preguntas competenciales y cómo enfrentarlas?
Descubre todos los modelos de examen de la nueva selectividad PAU 2025 y 2026, actualizados por comunidades autónomas. Incluye ejemplos oficiales, preguntas competenciales y consejos para practicar con los nuevos formatos de examen.
Ejercicios de Estequiometría: Test Online para Entender Moles, RL y Disoluciones
🧪 Ejercicios de Estequiometría para Pensar (y Entender de Verdad la Química) 🌟 Practica la estequiometría con ejercicios autocorregibles, explicaciones claras y tests diseñados para que aprendas razonandoEste post no es solo teoría: es un campo de prácticas de...
🎓 ¿Por qué nuestros materiales son una herramienta imprescindible?
- Diseñados por Docentes Expert@s:
Creados por profesor@s que conocen a fondo los exámenes y han seleccionado y organizado toda la información relevante para que te prepares con confianza. - Visuales, Memorables y Complejos:
Nuestros apuntes, esquemas y ejercicios están diseñados con un enfoque visual para facilitar la comprensión y la memorización, ideal tanto para estudiar en profundidad como para una rápida revisión antes del examen. - Contenido Completo y Conciso: Resúmenes claros, ejercicios resueltos y esquemas organizados en un formato fácil de manejar. Todo lo que necesitas para estudiar de manera eficiente está resumido en un solo lugar.
- Ejercicios y Exámenes Resueltos: Incluimos ejercicios interactivos, exámenes de convocatorias anteriores resueltos y organizados por bloques. Practica y refuerza lo aprendido de manera práctica y efectiva.
- Esquemas Aclaratorios: Esquemas que simplifican los conceptos más complejos, permitiéndote comprender y repasar con mayor facilidad.
Química PAU: elige tu pack y empieza hoy
Desde 20 € · acceso inmediato · material actualizado a la última convocatoria
-
Exámenes (20 €)
-
Apuntes Plus (40 €)
-
Vídeo Cursos (99 €)
-
PAU 360º (99 € + 20 €/mes)
¿Clases en directo o particulares? Haz clic aquí.
¿Te ha gustado el post? Si es así, déjanos un comentario. Durante este curso escolar, continuaremos brindándote recomendaciones y recursos para prepararte las pruebas de selectividad y PCE. ¡Ánimo en tu camino de aprendizaje! Recuerda que abordar los temas poco a poco con amor y curiosidad hará que tu viaje sea mucho más placentero.
Si te sientes perdid@, no dudes en pedir ayuda. ¡Nos apasiona lo que hacemos y estamos aquí para apoyarte en tu éxito académico!

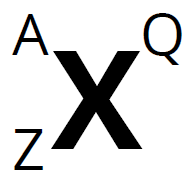 A: nºmásico; Z: nºatómico; Q: carga
A: nºmásico; Z: nºatómico; Q: carga